神経系による免疫制御の細胞・分子基盤
「病は気から」ということわざがあるように、神経系が免疫応答を制御する仕組みが存在することは古くから指摘されてきました。しかし、神経系からの入力がどのようにして免疫系に影響をおよぼすのか、その細胞および分子レベルでのメカニズムは十分に理解されていません。そこで私達は、神経系による免疫制御の細胞・分子基盤を解明することを目標として研究に取り組んでいます。
交感神経は副交感神経とともに自律神経系を構成し、全身の臓器の機能を協調させる役割を果たしています。交感神経はリンパ器官にも投射しており、リンパ器官を構成する免疫細胞には交感神経から放出される神経伝達物質ノルアドレナリンの受容体(主にβ2アドレナリン受容体)が発現しています。したがって、リンパ器官において交感神経系と免疫系の直接的な接点が形成されていると考えられます。しかし、リンパ節に投射する交感神経が免疫細胞の挙動にどのような影響をおよぼすのかは不明でした。このような背景のもとで、私達はこれまで交感神経による免疫制御の仕組みについて研究を行ってきました。
免疫細胞の一種であるリンパ球は、リンパ節を中継基地としてリンパ液、血液に乗って全身をめぐり、病原体の侵入を監視しています。私達はマウスを用いた研究から、リンパ節に投射する交感神経からノルアドレナリンが放出されると、リンパ球のリンパ節からの流出が抑えられることを見つけました(J. Exp. Med. 2014)。そのメカニズムとして、リンパ球に発現するβ2アドレナリン受容体が活性化されるのに伴って、ケモカイン受容体CCR7およびCXCR4の反応性が上昇する結果、リンパ球がリンパ節に引き留められることがわかりました(図1).
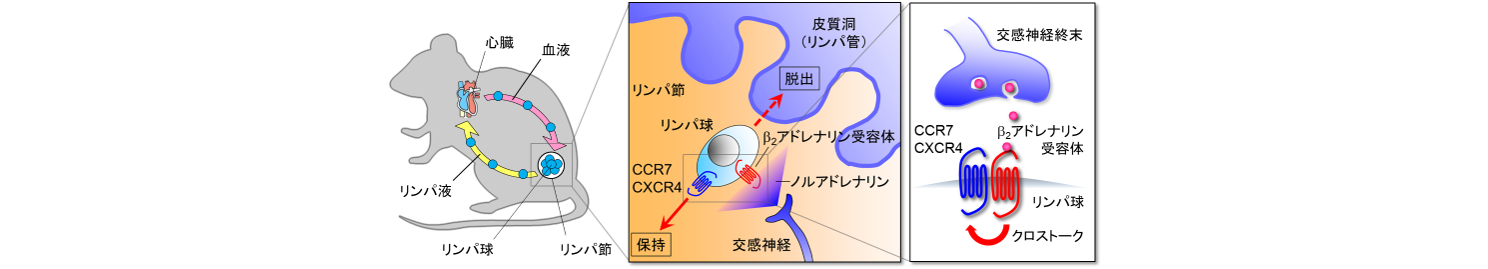
図1.交感神経によるリンパ球の動態制御
交感神経の活動は身体の活動性に合わせて変動し、ヒトの場合には昼間に、マウスのような夜行性の動物の場合には夜にピークに達します。私達は、マウスの体内で交感神経の活動が高まる夜になると、リンパ球のリンパ節からの流出が抑えられる結果、リンパ節のリンパ球数が昼間に比べて増えることを見つけました。そこで夜にマウスを免疫したところ、リンパ節のリンパ球数の増加を反映して昼間に比べて強い免疫応答が起こりました。これらの結果から、交感神経によるリンパ球の動態制御の仕組みが、免疫応答の日内変動を生み出すことが明らかになりました(J. Exp. Med. 2016)。
多くの動物にとって、交感神経の活動が高まる時間帯は身体の活動性の高まりとともに病原体に遭遇するリスクも高まる時間帯です。このような時間帯に、リンパ節においてより強い免疫応答を起こす準備ができているということは、感染防御という観点から非常に理にかなっています。したがって、交感神経によるリンパ球の動態制御の仕組みと、それによって生み出される免疫応答の日内変動は、神経系と免疫系が相互作用しながら進化する過程で編み出された生物の生存戦略なのではないかと私達は考えています(図2)。
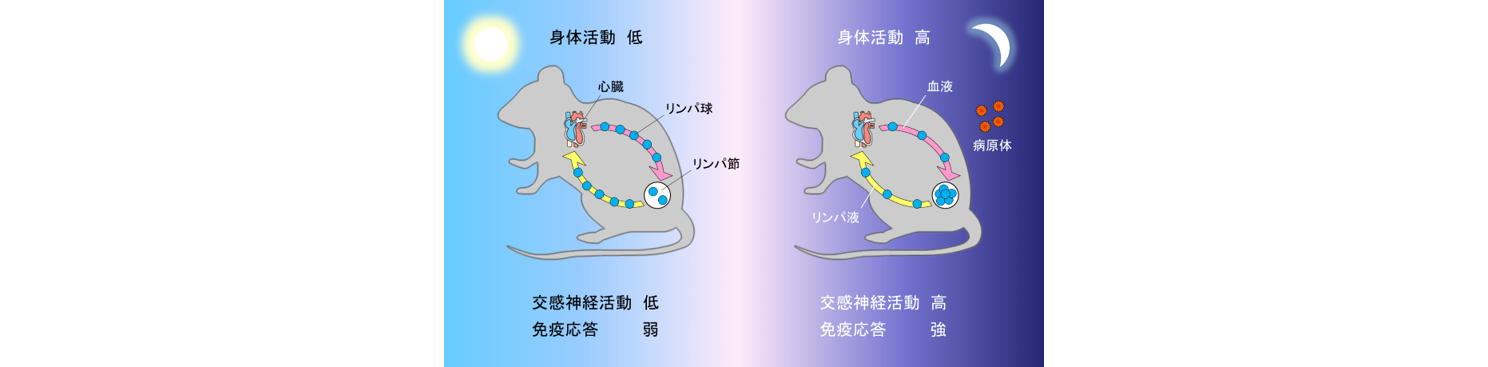
図2.交感神経による免疫応答の日内変動
リンパ球の移動を標的とした自己免疫疾患の治療法開発
Gタンパク共役型受容体(G protein-coupled receptor, GPCR)は、Gタンパクと呼ばれるタンパクを介してシグナル伝達を行う受容体で、800種類以上が知られており、様々な生理機能の発現や病態の形成に関わっています。免疫細胞の移動をつかさどるケモカイン受容体もGPCRの一種です。私達は、交感神経によるリンパ球動態の制御機構を研究するのと並行して、リンパ球の体内動態の制御に関わる分子の探索を行ってきました。その過程で、ケモカイン受容体の細胞内領域に会合する分子として、copper metabolism MURR1 domain-containing(COMMD)3とCOMMD8からなるタンパク複合体(COMMD3/8複合体)を同定しました(J. Exp. Med. 2019)。
COMMD3/8複合体の機能を解析した結果、COMMD3/8複合体がGPCR kinase(GRK)6というシグナル伝達分子をケモカイン受容体に呼び寄せることによってケモカイン受容体のシグナル伝達を促進することを突き止めました。GRKには1から7まであり、どのGRKがGPCRに呼び寄せられるかによってGPCRのシグナル伝達が細胞機能におよぼす影響が異なります。しかし、これまでどのGRKがGPCRに呼び寄せられるのか、つまりGRKのGPCRに対する選択性を決めるメカニズムは不明でした。私達の研究は、COMMD3/8複合体がGRK6のGPCRに対する選択性を規定する因子として働くことを示し、GRKのGPCRに対する選択性を決めるメカニズムの一つを明らかにしました(図3)。
ケモカイン受容体によって制御されるリンパ球の移動は免疫応答に大きな影響をおよぼすことから、私達はCOMMD3/8複合体を欠損するマウスの体内におけるリンパ球の移動と免疫応答を解析しました。その結果、COMMD3/8複合体を欠損するマウスでは活性化B細胞(リンパ球の一種)の移動が異常を示すのにともなって、免疫応答が著しく低下することがわかりました。このことから、COMMD3/8複合体が生体内でのリンパ球の移動と免疫応答の成立にきわめて重要な役割を果たしていることが明らかになりました(J. Exp. Med. 2019)。
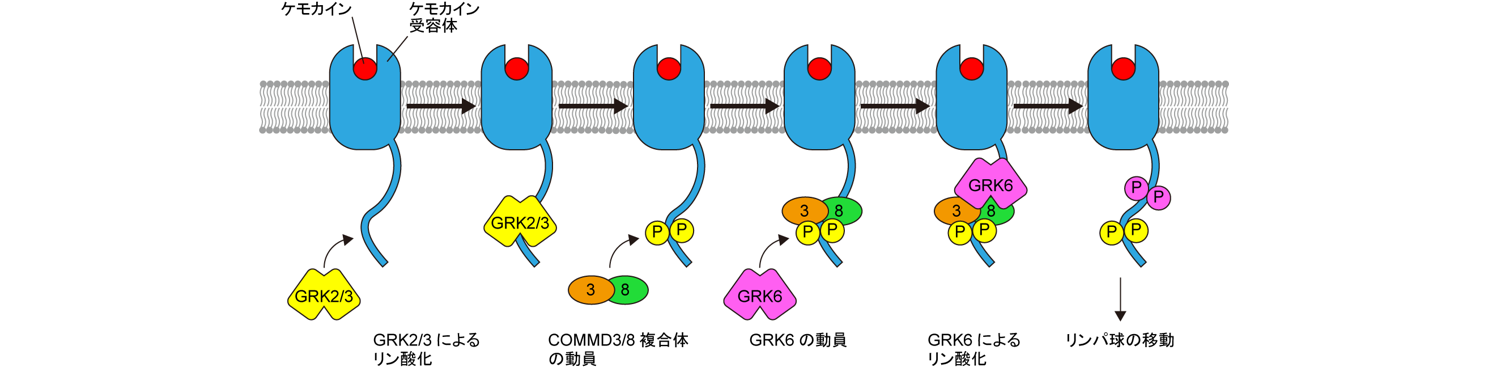
図3.COMMD3/8複合体の作用メカニズム
免疫系は本来、病原体などの異物を排除することによって私達の体を守る仕組みです。しかし、免疫系の異常により免疫応答の矛先が自己の組織に向かい、組織の機能が障害されてしまうことがあり、このような病気を自己免疫疾患と呼びます。代表的な自己免疫疾患である関節リウマチと同様の症状を呈するマウス(関節リウマチモデルマウス)でCOMMD3/8複合体を欠損させると、関節炎の進行が抑えられたことから、COMMD3/8複合体が自己免疫疾患の病態の悪化に関わることが明らかになりました(Sci. Immunol. 2023)。
このことは、COMMD3/8複合体の働きを抑える薬剤が自己免疫疾患の治療薬になる可能性を示唆しています。そこで、COMMD3/8複合体の働きを抑える化合物を探索した結果、セラストロールという化合物を同定しました(図4)。セラストロールは、抗炎症性の生薬ライコウトウの主要な薬効成分ですが、その薬理作用のメカニズムは十分に解明されていませんでした。セラストロールを関節リウマチモデルマウスに投与することによって、COMMD3/8複合体を欠損させた場合と同様に関節炎の進行が抑えられたことから、セラストロールがCOMMD3/8複合体を標的として自己免疫疾患の病態を改善することがわかりました(Sci. Immunol. 2023)。
これらの結果から、COMMD3/8複合体が自己免疫疾患の治療ターゲットになり得ることが示されました。私達は今後、COMMD3/8複合体を標的とした自己免疫疾患の新たな治療法の開発を進めて行きます。
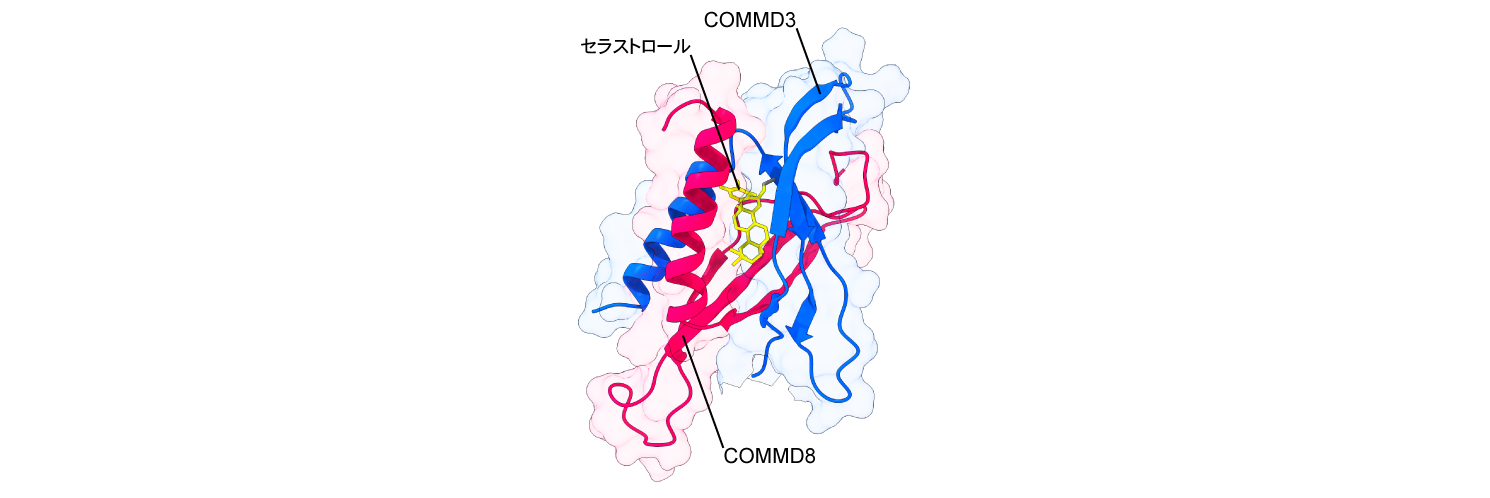
図4.セラストロールとCOMMD3/8複合体の結合
